
产地:ABC
货号:ABC3631
规格:50 T
备注:可对PCR体系和酶切体系进行200 bp-1500 bp DNA片段的纯化与分选,操作简单快捷
本试剂盒利用超顺磁性磁珠高效吸附核酸的特性,再配合特别优化的缓冲体系,通过添加不同比例的分选液,可进行200 bp-1500 bp DNA片段的纯化与分选,整个操作过程简单、快捷,可对PCR体系、酶切体系的DNA纯化等,通过分选获得的DNA片段可广泛应用于NGS(Next Generation Sequencing)文库构建。
冰袋(wet ice)运输,2-8℃储存;有效期12个月。
1. 使用前请配置80%乙醇,最好现配现用。
2. 自备磁力架。
一、DNA片段纯化步骤
1. 提前将DNA片段分选试剂从2-8℃取出,使其温度恢复至室温;
2. 上下颠倒DNA片段分选试剂,使磁珠分散均匀,向DNA样品中加入1.8倍体积的DNA片段分选试剂,用移液器轻轻吹打至磁珠分散均匀,室温静置5 min,期间使用移液器吹打混匀2-3次;
3. 将离心管置于磁力架上30 s,待上清清澈后,吸弃上清;
4. 加入200 µL 80%的乙醇,移开磁力架,使用移液器吹打至磁珠分散均匀,将离心管移至磁力架上静置30 s,待上清清澈后,吸弃上清;
5. 重复步骤4;
6. 将离心管盖打开,室温晾干5-10 min,使乙醇完全挥发(避免磁珠过度干燥,以免影响核酸得率);
7. 移去磁力架,向离心管加入20-50 μL Buffer TE或Nuclease-free Water,使用移液器吹打至磁珠分散均匀,室温静置5 min;
8. 将离心管移至磁力架上至磁珠全部吸附至管壁,吸取上清至一新的离心管中,即得高纯度的DNA。
二、DNA片段分选步骤
1. 提前将DNA片段分选试剂从2-8℃取出,使其温度恢复至室温;
2. 第一次结合:上下颠倒DNA片段分选试剂,使磁珠分散均匀,根据需要得到的片段范围按照表1加入第一次片段分选试剂用量;
3. 用移液器轻轻吹打至磁珠分散均匀,室温静置5 min,期间使用移液器吹打混匀2-3次;
4. 将离心管置于磁力架上30 s,待上清清澈后,将上清转移至一新的离心管中;
备注:样本量×第一次分选试剂用量比例=分选液加入量,如100 µL样本× 0.6=60 µL分选液;
5. 第二次结合:根据表1向上述离心管中加入0.1倍样体积的DNA片段分选试剂;
备注:样本量×第二次片段分选试剂用量比例=分选液加入量,如100 µL样本× 0.1=10 µL分选液;
6. 用移液器轻轻吹打至磁珠分散均匀,室温静置5 min,期间使用移液器吹打混匀2-3次;
7. 将离心管置于磁力架上30 s,待上清清澈后,吸弃上清;
8. 加入200 µL 80%的乙醇,移开磁力架,使用移液器吹打混匀,将离心管移至磁力架上静置30 s,待上清清澈后,吸弃上清;
9. 重复步骤8;
10. 将离心管盖打开,室温晾干5-10 min,使乙醇完全挥发(避免磁珠过度干燥,以免影响核酸得率);
11. 去掉磁力架,向离心管加入30-50 μL Buffer TE或Nuclease-free Water,使用移液器轻轻吹打至磁珠分散均匀,室温静置5 min;
12. 将离心管移至磁力架上至磁珠全部吸附至管壁,吸取上清至一新的离心管中,即得高纯度的DNA。
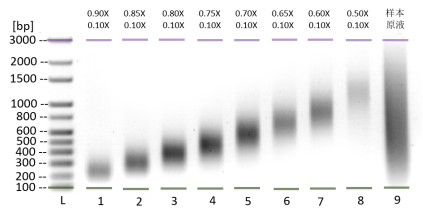
表1:DNA片段分选推荐分选液用量表
| 分选片段平均长度(bp) | 200-300 | 250-350 | 300-450 | 400-550 | 500-700 | 600-800 | 800-1000 | 1000-1500 |
| 第一次片段分选试剂用量 | 0.9× | 0.85× | 0.8× | 0.75× | 0.7× | 0.65× | 0.6× | 0.5× |
| 第二次片段分选试剂用量 | 0.1× | 0.1× | 0.1× | 0.1× | 0.1× | 0.1× | 0.1× | 0.1× |

1. 操作之前,请务必认真阅读本产品说明书。
2. DNA片段分选样本量低于100 µL,可加水补至100 µL,样本量过少易使磁珠实际加入量不准,进而影响分选效果。
3. 磁珠易沉淀,使用前务必混匀。
4. 磁珠悬液在保存过程中避免冷冻。
5. 洗脱前,应使乙醇完全挥发,避免残留的乙醇影响下游实验。
6. 请勿长时间干燥磁珠,以免影响DNA洗脱效率。
7. 为了您的安全和健康,请穿实验服并戴一次性手套操作。
本产品仅供科研用途,不用于临床诊断!
(产品包装升级中,以实物为准。)


































爱必胜生物科技(东莞)有限公司 © 版权所有
技术支持:网一科技