

产地:ABC
货号:ABC1525
规格:100T
备注:可用于凋亡晚期检测




| 产品名称 | 产品编号 | 规格 |
| DAB (SA-HRP) Tunel Cell Apoptosis Detection Kit | ABC1525 | 100T |
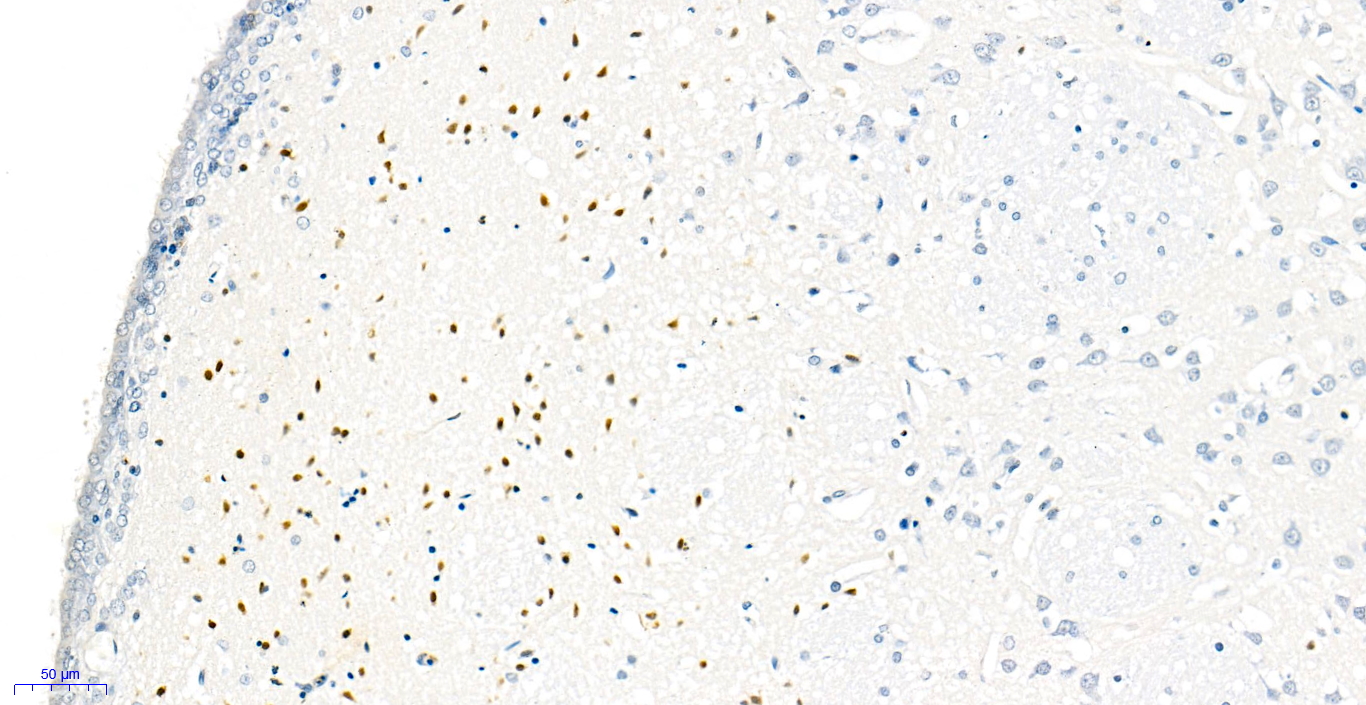
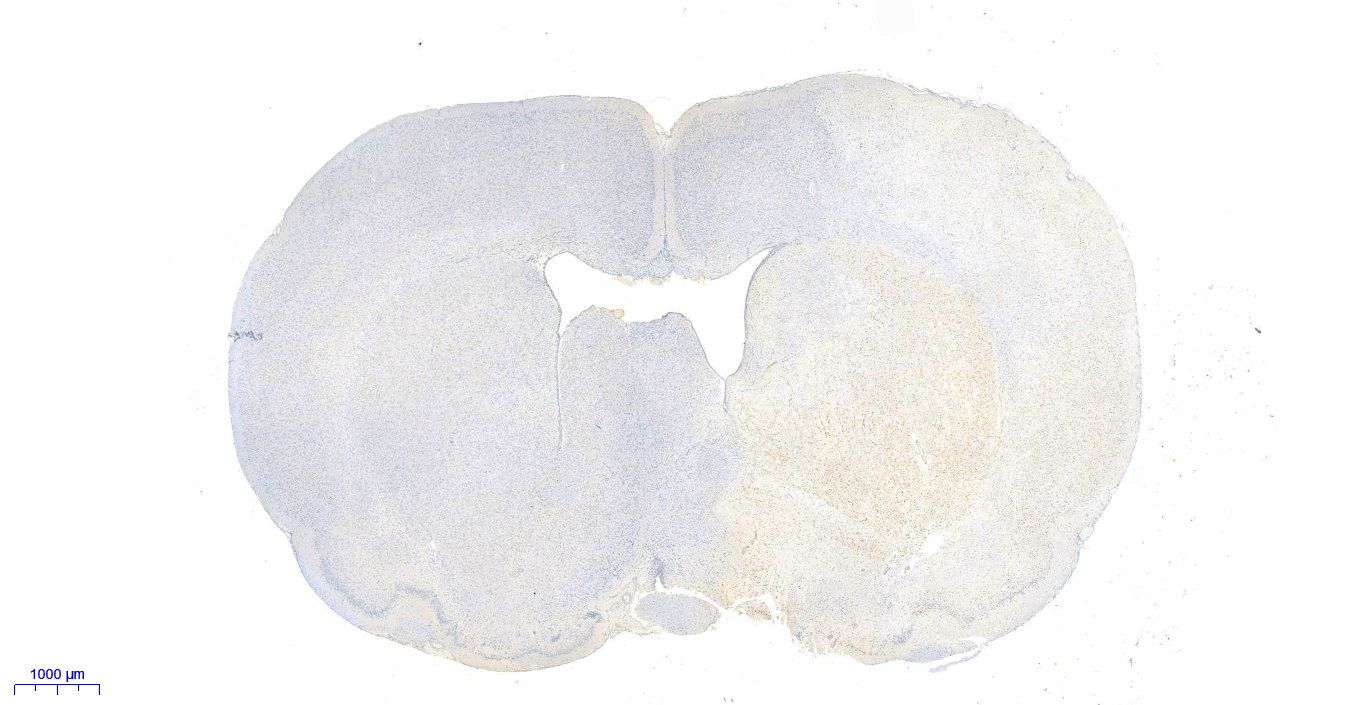
细胞凋亡中染色体DNA的断裂是个渐进的阶段性过程。染色体DNA首先在内源性的核酸水解酶的作用下降解为50-300 kb的大片段,然后大约30%的染色体DNA在Ca2+和Mg2+依赖的核酸内切酶作用下,在核小体单位之间被随机切断,形成180-200 bp核小体DNA多聚体。因此在细胞凋亡晚期,DNA会被降解为180-200 bp的片段,断裂的基因组DNA上暴露出大量的3'-OH末端。末端脱氧核糖核苷酸转移酶(Terminal Deoxynucleotidyl Transferase, TdT)是一种不依赖于模板的DNA聚合酶,可以催化脱氧核苷酸结合到断裂的DNA分子3'-OH末端。因此TUNEL (TdT mediated dUTP Nick End Labeling)细胞凋亡检测试剂盒可以用来检测组织细胞在凋亡晚期过程中细胞核DNA的断裂情况。其原理是在TdT酶的作用下,在基因组DNA断裂时暴露出的3´-OH末端掺入生物素标记的dUTP(Biotin-dUTP),随后用辣根过氧化物酶(Horse-radish peroxidase,HRP)标记的链霉亲和素(Streptavidin)(Streptavidin-HRP, SA-HRP),检测被生物素(Biotin)标记的DNA末端,最后通过加入HRP的底物混合液(DAB)进行显色反应,使得凋亡细胞的细胞核被染成棕黄色,从而可以用普通光学显微镜检测。本试剂盒应用范围广,适用于石蜡组织切片,冰冻组织切片、细胞爬片、细胞涂片等的细胞凋亡检测。
冰袋(wet ice)运输;
本试剂盒储存在-20℃,有效期12个月。
| Component Number | Component | ABC 1525-50T | ABC 1525-100T |
| ABC 1525-1 | Recombinant TdT Enzyme | 50 µL | 2×50 µL |
| ABC 1525-2 | Biotin-dUTP Labeling Mix | 250 µL | 2×250 µL |
| ABC 1525-3 | Equilibration Buffer | 5×1 mL | 10×1 mL |
| ABC 1525-4 | Streptavidin-HRP | 25 µL | 2 ×25 µL |
| ABC 1525-5 | Proteinase K(200 µg/mL) | 1 mL | 2×1 mL |
| 产品说明书 | 1份 | ||
1. PBS磷酸盐缓冲液;
2. 固定液:溶于PBS的4%多聚甲醛,pH 7.4;
3. 破膜液:0.1%-0.5% Triton X-100;
4. 如需染核,需自备DAPI(2 µg/mL)或PI(1 µg/mL);
5. 如需阳性对照实验,需自备DNase I;
6. 如果用流式细胞仪,自备PI染液和RNase A(DNase free);
7. 操作时请穿实验服,佩戴一次性手套。
一、样品准备
A. 石蜡包埋组织切片
1. 室温下将石蜡组织切片放入二甲苯中浸泡5-10 min,重复2-3次;然后无水乙醇浸泡5 min,重复2次;最后用梯度乙醇(85%、75%)、双蒸水各浸泡1次,每次5 min;
2. 用PBS轻轻润洗切片,并去掉样本周围多余液体。使用组化笔沿组织外围轮廓画一个与组织间隔2-3 mm的小圈,便于下游通透性处理和平衡标记操作。在实验过程中,切勿让样本干燥,处理好的样本放在湿盒中保持样本的湿润;
3. 配制Proteinase K工作液:按1:9体积比,用PBS作为稀释液来稀释Proteinase K(200 µg/mL)原液,使其终浓度为20 μg/mL;
4. 每个样本上滴加100 μL上述Proteinase K工作液,完全覆盖组织,37℃孵育20 min;
(注:Proteinase K处理主要有助于组织和细胞后续步骤的染色试剂通透,其孵育时间过长过短都会影响后续标记效率,为得到更好的结果,可以优化Proteinase K孵育的时间)
5. 用PBS溶液浸润清洗样本3次,每次5 min(Proteinase K需洗涤干净,否则会干扰后续的标记反应),处理后的样本放在湿盒中保持样本的湿润;
6. (可选步骤)去掉样本上多余的液体,将适量破膜液滴加到组织上,充分浸润组织,室温处理20 min;破膜处理完成后同样的用PBS溶液润洗样本3次,每次5 min;处理后的样本放在湿盒中保持样本的湿润。
7. 去掉样本上多余的液体,将适量3%的H2O2(PBS配制)滴加到组织上,充分浸润组织,室温处理20 min(灭活组织内源的过氧化物酶,孵育时间不宜过长,否则会出现过氧化氢导致的DNA断裂,从而产生假阳性);然后使用PBS溶液润洗样本3次,每次5 min;处理后的样本放在湿盒中保持样本的湿润。
B. 组织冰冻切片
1. 将玻片浸没在4%多聚甲醛溶液(溶于PBS)中固定,室温下孵育10-15 min;
2. 片子从固定液中取出后,通风橱中自然晾干;
3. 将玻片放入纯水或PBS中润洗,去掉玻片上残存的固定液;
4. 用组化笔沿着组织外围轮廓画一个与组织间隔2-3 mm的小圈,便于下游通透性处理和平衡标记操作;在实验过程中,切勿让样品干燥,处理好的样本放在湿盒中保持样本的湿润;
5. 配制Proteinase K工作液:按1:9的比例,用PBS作为稀释液来稀释Proteinase K(200 µg/mL)原液,使其终浓度为20 μg/mL;
6. 每个样本上滴加100 μL上述Proteinase K工作液,使其被全部覆盖,室温孵育10 min;
(注:Proteinase K处理主要有助于组织和细胞后续步骤的染色试剂通透,其孵育时间过长过短都会影响后续标记效率,未得到更好的结果,可能需要优化Proteinase K孵育的时间)
7. 用PBS溶液润洗样本2-3次,去掉多余液体(Proteinase K需洗涤干净,否则会干扰后续的标记反应),处理后的样本放在湿盒中保持样本的湿润;
8. (可选步骤)将适量破膜液滴加到组织上,充分浸润组织,室温处理20 min,破膜处理完成后同样的用PBS溶液润洗样本,去掉多余液体,处理后的样本放在湿盒中保持样本的湿润;
9. 去掉样本上多余的液体,将适量3%的H2O2(PBS配制)滴加到组织上,充分浸润组织,室温处理20 min(灭活组织内源的过氧化物酶,孵育时间不易过长,否则会出现过氧化氢导致的DNA断裂,从而产生假阳性);然后使用PBS溶液润洗样本3次,每次5 min;处理后的样本放在湿盒中保持样本的湿润。
C. 细胞爬片
1. 在Lab-Tek载玻片小室(Chamber Slides)上培养贴壁细胞,在凋亡诱导处理之后,用PBS轻轻润洗2遍载玻片;
2. 向每个载玻片小室中加入适量的4%多聚甲醛溶液(溶于PBS)固定,室温下孵育20 min;
3. 去掉固定液,加入PBS清洗3次,每次5 min;
4. 每个样本浸于破膜液中,室温孵育5 min进行通透处理(注意:推荐用2-20 μg/mL的Proteinase K工作液消化,37℃处理10 min左右,视细胞状态调整。若细胞易掉片则建议选择用破膜液处理);
5. 在盛有PBS溶液的敞口烧杯中浸没清洗样本2-3次;向每个载玻片小室中加入适量的3%的H2O2(PBS配制),室温处理20 min;
6. 轻轻去掉多余液体,加入PBS清洗3次,每次5 min;并用滤纸小心吸干载玻片上样本周围的液体。处理后的样本放在湿盒中保持样本的湿润。
D. 细胞涂片
1. 以约2×107个细胞/mL的浓度将细胞重悬于PBS中,吸取50-100 μL细胞悬液滴于防脱玻片上,使用一片洁净的载玻片轻柔涂开细胞悬液;
2. 将玻片浸入装有4%新鲜配制于PBS中的多聚甲醛的染色缸中,固定细胞,在4℃放置25 min;
3. 将玻片浸入PBS中,室温放置5 min浸洗,重复一次;
4. 每个样本浸于破膜液中,室温孵育5 min进行通透处理(注意:推荐用2-20 μg/mL的Proteinase K工作液消化,37℃处理10 min左右,视细胞状态调整。若细胞易掉片则建议选择用破膜液处理);
5. 在盛有PBS溶液的敞口烧杯中浸没清洗样本2-3次;每个样本加入适量的3%的H2O2(PBS配制),室温处理20 min;
6. 轻轻去掉多余液体,加入PBS清洗3次,每次5 min;最后用滤纸小心吸干载玻片上样本周围的液体。处理后的样本放在湿盒中保持样本的湿润。
二、DNase I处理阳性对照实验(可选步骤)
在样本通透处理后,用DNase I处理样本来准备阳性对照。
1. 将100 μL 1×DNase I Buffer(配制方法:取10 μL 10×DNase I Buffer,然后加入90 μL去离子水混匀)滴加到已通透的样本上,室温孵育5 min;
2. 轻轻去掉多余液体,加入100 μL含有DNase I(20 U/mL)的工作液(配制方法:取10 μL 10×DNase I Buffer,然后加入2 μL DNase I,再加入88 μL去离子水混匀),室温孵育10 min;
3. 轻轻去掉多余的液体,并将载玻片在装有PBS的染色缸中彻底洗3-4次。
(注:阳性对照载玻片必须使用单独的染色缸,否则阳性对照载玻片上残留的DNase I可能会在实验载玻片上引入高背景)
三、标记与检测
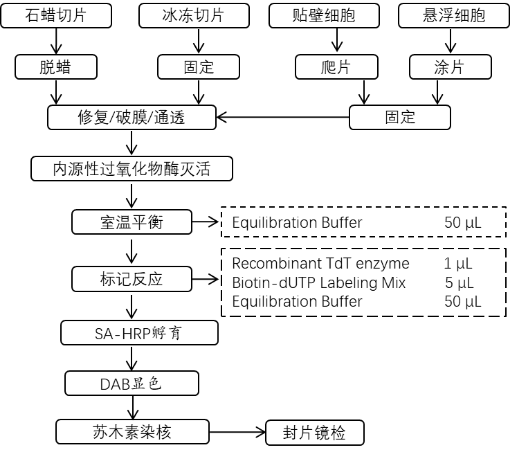
1. 平衡:每个样本滴加50 μL Equilibration Buffer使其全部覆盖待检样本区域,室温孵育10 min;
2. 标记液配制:在冰上解冻Biotin-dUTP Labeling Mix和Equilibration Buffer,并按照Recombinant TdT enzyme:Biotin-dUTP Labeling Mix:Equilibration Buffer=1 µL:5 µL:50 µL(1:5:50)比例混合足够用于所有实验的TdT孵育缓冲液,具体实验使用试剂的体积可以根据玻片的大小进行适当等比例调整;
3. 阴性对照体系:准备一份不含Recombinant TdT enzyme的对照TdT孵育缓冲液,用ddH2O替代;
4. 标记:尽量去掉平衡的Equilibration Buffer,然后在每份组织样本上加入56 μL TdT孵育缓冲液,在37℃孵育1 h;注意不能干片,载玻片要避光;
5. 立即用PBS润洗组织样本,清洗4次,每次5 min;
6. 用滤纸轻轻擦掉样本周围的PBS溶液;
7. Streptavidin-HRP反应:甩干玻片后,每个样本组织滴加100 µL(浸润组织)Streptavidin-HRP反应液(Streptavidin-HRP:TBST=1:200-500比例提前稀释),37℃孵育30 min;
8. PBS清洗样本,清洗3次,每次5 min;
9. DAB显色:配制DAB显色工作液(现配现用)。每个样本滴加50-100 µL DAB显色工作液,将切片置于显微镜下实时观察显色情况,待阳性显现后立即将片子放置湿盒中,用纯水清洗终止反应;
10. 苏木素染核:切片进入在苏木素染液染色3-5 min,立即用纯水洗涤,经苏木素分化液分化约2 s,立即纯水洗涤,然后经苏木素返蓝液返蓝数秒,纯水洗涤干净(染核完成后需在显微镜下进行镜检,如染色过深,则回到分化液再次分化;如果染色偏浅,则从苏木素染核开始重新染色即可);
11. 透明:样本经4次新鲜无水乙醇进行脱水,每次5 min;经正丁醇中浸泡5 min,放入二甲苯中透明5 min,更换新鲜二甲苯再次透明5 min;
12. 封片:使用中性树胶对切片封片,自然晾干或60℃烘箱烘干;
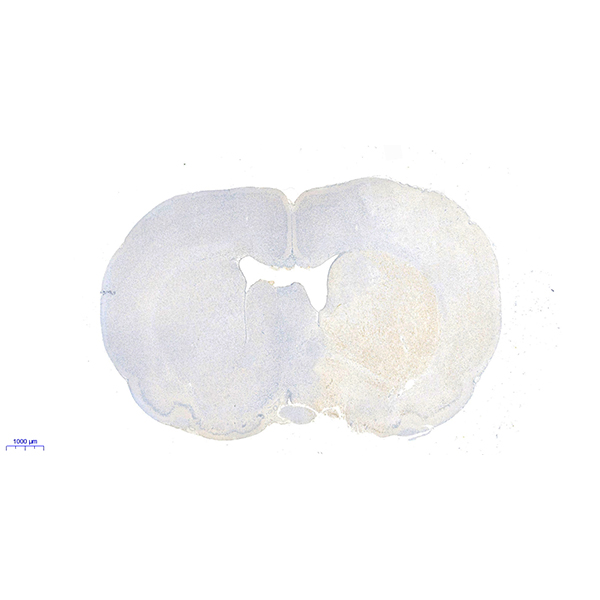
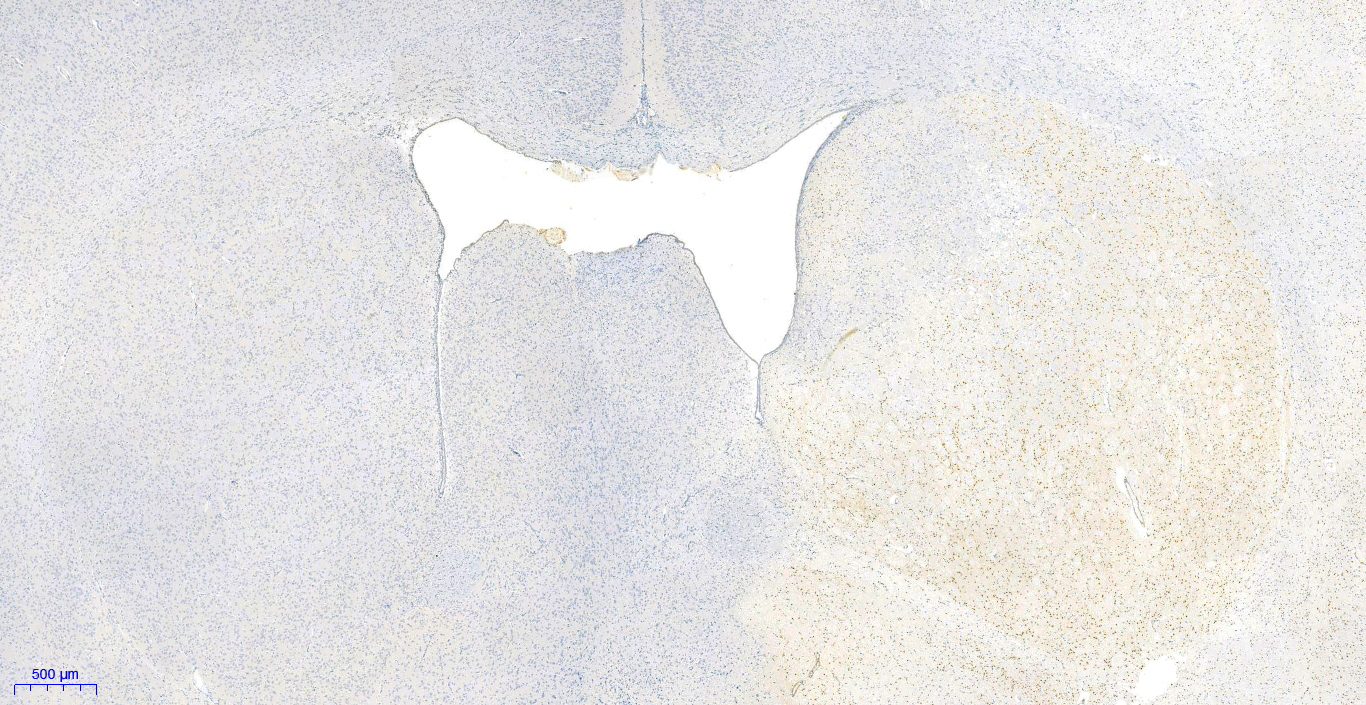
13. 镜检:样本使用白光显微镜进行镜检(发生凋亡的阳性细胞核被染成棕黄色,正常的阴性细胞核被染成蓝色)。
四、实验流程简图
本产品仅供科研用途,不用于临床诊断!
(产品包装升级中,以实物为准。)














爱必胜生物科技(东莞)有限公司 © 版权所有
技术支持:网一科技